天津个人做网站/全面网络推广营销策划

● 原料药的研发流程介绍——培优精选|研发技术系列47
● PPT 原料药生产GMP管理——培优精选|原辅包系列35
● 高变异药品及其参比制剂校正的平均生物等效性试验的探讨——培优精选|BE系列51
● 新药研发基本流程——培优精选|研发技术系列46
● 欧洲药典第十版要来了,你准备好了吗?

[摘要]目的 评价不同方差分析方法对生物等效性结论的影响。方法对方差分析的原理进行分析对比,通过实例使用不同程序进行方差分析并对获得的结果进行比较。结果两种方差分析下方法并不影响最终的生物等效性结论。但不考虑序列效应的方差分析方法,获得的结论有时不能被监管部门接受,另外也无法计算个体问变异。通过对方差分析原理的认识,可以避免出现不符合2×2交叉试验设计和数据处理要求的情况发生。结论 在生物等效性统计中,应使用包含序列效应的方差分析方法进行分析。
[关键词]生物等效性;方差分析:序列效应
在开展生物等效性研究中,两周期、两序列的交叉试验设计,又称2×2交叉设计,是最常采用的研究设计。本文旨在通过对国际上通用的方差分析原理进行解析,帮助研究人员了解2×2交叉试验设计的要求和其中的假设,在开展生物等效性研究时避免相关问题的发生。
1 研究背景
试验结束后,通过对获得的药代动力学参数进行统计学上的假设检验和置信区间判断,可以确定受试制剂和参比制剂是否具有生物等效性。进行置信区间判断时,需要首先进行方差分析。国内已有教科书或专著介绍的方差分析中[1-2],分析的因素(效应)有受试者(个体间)、周期、处方(制剂);国内较常使用一些软件在进行方差分析时,同样考察这些效应。以上分析均没有包括序列效应的分析。但目前国际上一些生物等效性统计方法,在进行方差分析时包括受试者、周期、制剂间效应以及序列效应的分析。由于方差分析过程中的残差项(误差均方)是用来估计置信区间的大小,需要确定不同的方差分析方法所得的结果是否会影响最终的生物等效性分析结论。另外,有研究者在开展生物等效性时,如发 现受试者在试验期间脱落,导致生物等效性研究的 受试者例数可能不足时,就采用了随后追加个别受试者参加试验的方法(非两阶段设计);还有的研究者在开展生物等效性研究中,因单位的条件有 限,如床位数量不足,将参加试验的受试者分成2批或更多批,按照时间的先后分批进行,且批与批的间隔时间较长,有的研究甚至是在第一批受试者的两个周期完成后再开展下一批受试者的试验,但在统计时是将不同时间完成的受试者算做一个周期进行统计;还有的研究者将生物等效性试验设计成三交叉试验(如一个参比制剂和两个受试制剂),但在等效性判断时,采用的是2×2交叉试验设计的方法。针对以上的情况,需要通过方差分析的原理来说明这些试验设计或数据处理方法是否会影响生物等效性的判断。近年来,生物等效性研究成本已大幅提高,如果因设计或数据处理不当,导致生物等效性研究无法评价或评价无效时,将给申办单位带来时间和经济上的重大损失。
2 药代动力学参数的分布
在药代动力学参数处理时,通常是假设这些参数(tmax除外)符合对数正态分布,即将这些参数取对数转换后,可以用基于正态分布的统计学理论进行数据处理。一个正态分布函数可以用均值(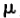 )和方差(
)和方差(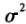 )来表示。在实际的生物等效性统计分析时,获得的不同个体药代动力学参数的数量是有限的,一般情况下,并不对这些数据是否符合对数正态进行检验。因此,不管药代动力学参数的原始分布如何,都推荐按照对数正态分布进行处理。
)来表示。在实际的生物等效性统计分析时,获得的不同个体药代动力学参数的数量是有限的,一般情况下,并不对这些数据是否符合对数正态进行检验。因此,不管药代动力学参数的原始分布如何,都推荐按照对数正态分布进行处理。
3 线性混合效应模型
线性混合效应模型可以分为固定效应和随机效应。对数转换后的药代动力学参数符合正态分布,因此,可以用线性混合效应的方法来处理。
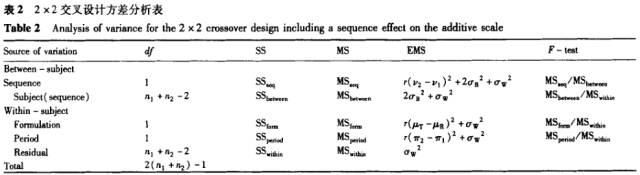
4 2×2交叉试验的方差分析
在严格的2×2交叉试验设计中,影响药代动力学参数的效应可以包括:携带效应、受试者(随序列)的效应、制剂效应、周期效应和残差。其中受试者随顺序的效应和残差是随机效应,其他效应是固定效应。表示的公式为:对数转换后的药代动力学参数=制剂效应+受试者(随序列)的效应+周期效应+携带效应+残差。
在生物等效性研究中,携带效应即第1周期给药对第2周期给药的影响,是很少发生的。因此,引人一个给药序列效应来代替携带效应。对数转换后的药代动力学参数=制剂效应+受试者(随序列)的效应+周期效应+序列效应+残差。

在该模型中,Is“和eiilc是随机效应,且是互相独立的,其他参数是固定效应。
2x2交叉试验设计的模型中,其参数的表达形式见表1。
对应的方差分析见表2,有关该表公式的具体推导过程,可以见文献[3]。表2中的数据还可以用于个体内和个体间变异的估算,这在受试者例数的估算中很有用,其计算公式如下:
个体内变异的估算为:
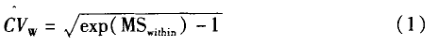
个体间变异的估算为:

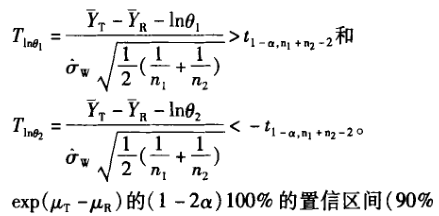
5 生物等效性中的假设检验和(1—2Q)100%的置信 区间的判断
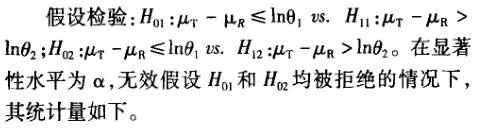

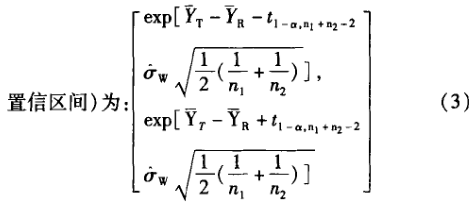
6 应用举例
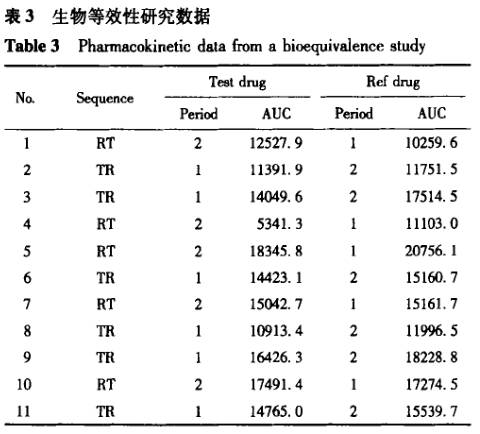
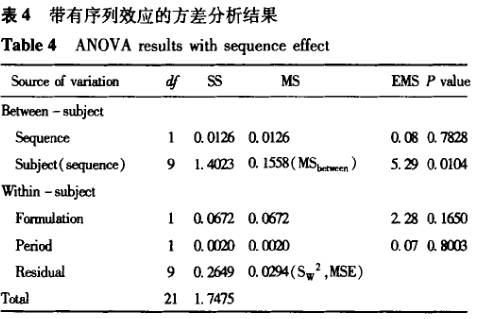
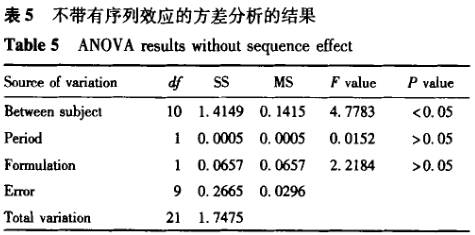
案例1 表3为一批来自预试验的生物等效性研究数据,用包括序列效应的方差分析进行统计,结果见表4。根据方程③计算所得的90%置信区间为 78.2163%一102.3925%;根据方程①计算的个体内变异估计值为17.3%;根据方程②计算的个体间变异估计值为25.5%。而依据不包括序列效应[1-2]。编辑的程序(经验证)计算的结果见表5,根据方程③计算得到的90%置信区间为78.37%~102.55%;根据方程①计算得到的个体内变异估计值为17.3%;由于未提供个体间序列 ,无法获得个体间变异。在本例子中,两种方差分析方法总误差和90%置信区间的计算结果一致(有效数字的区别),但其中周期、制剂间的分析结果是不一致的。
,无法获得个体间变异。在本例子中,两种方差分析方法总误差和90%置信区间的计算结果一致(有效数字的区别),但其中周期、制剂间的分析结果是不一致的。
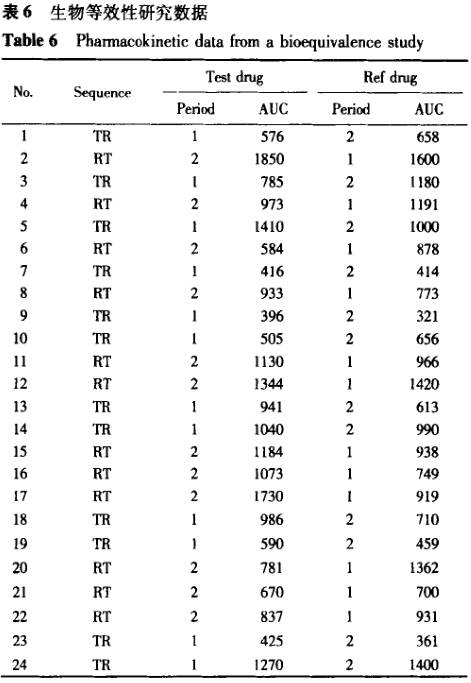
案例2 表6为一生物等效性研究中的数据,采用两种方差分析方法进行计算,结果见表7,8。数据结果显示,所计算的90%置信区间是完全一致的,即不影响生物等效性结果的判断,但带有序列效应的方差分析显示,所统计的试验数据中序列效应影响显著。不带有序列效应的方差分析方法未能检出序列效应的影响。在存在显著序列效应的影响时,按照美国食品和药物管理局(FDA)的要求[4],除非存在满足一些特定要求的情况,否则依据该数据做出的等效性结论是不能被接受的。
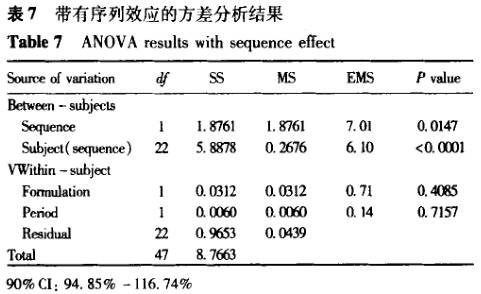
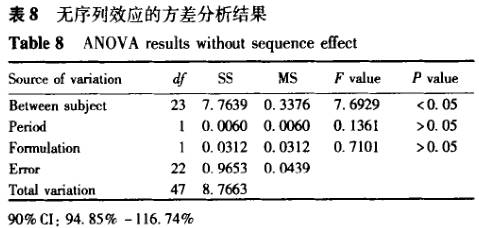
7 讨论
我国最近颁布的《化学药品新注册分类申报资料要求(试行)》[5]中已经规定,在生物等效性研究的方差分析中需要进行制剂、个体、周期及服药序列间的差异分析。
有一些生物等效性研究需要在病人中进行,而所有病人完成人组需要经历一个非常长的间期,这期间周期效应如何估算,应予以考虑。显然将多个周期的数据混合在一起,分成两个周期,套用2x2交叉试验设计的计算方法是不合理的。对于此种情况,FDA在其指导原则[4]中要求申办单位在开展该项试验前,需要和其讨论。
对于一个参比制剂和2个或以上的受试制剂之间的等效性分析,因存在更多的效应因素,使用2×2交叉试验设计的方差分析方法也是不合理的。在生物等效性分析中,按照周期、制剂、给药序列对药代动力学参数进行绘图比较,有利于发现所进行的研究中,是否存在这些因素的影响。当存在序列因素的显著性影响时,此时需要对生物等效性研究结果进行额外的分析。FDA的指导原则[4]中指出,只有下列要求也同时满足时,如:所进行的生物等效性研究是仅在健康受试者中进行单剂量研究、所研究的药物不是内源性物质、清洗期足够、而且研究方案可接受、测试方法经过严格的确证、合适的统计分析以及在可接受的置信区间内,才能接受存在序列效应统计学差异的生物等效性研究结果。
参考文献略
来源:《中国临床药理学杂志》, 2016, 32(23):2195-2198
收稿日期:2016-09-24
作者单位:北京大学第一医院临床药理研究所 CFDA药品审评中心


免责声明:
本文信息部分内容来自网络文章,不保证所有信息、文本、图形、链接及其他项目的绝对准确性和完整性,故仅供访问者参照适用。如您(单位或个人)认为本文某部分内容有侵权嫌疑,敬请立即通知我们,我们将在第一时间予以更正或删除。以上声明之解释权归本公众号所有。法律上有相关解释的,以中国法律之解释为基准。如有争议限在我方所在地司法部门解决。谢谢。
